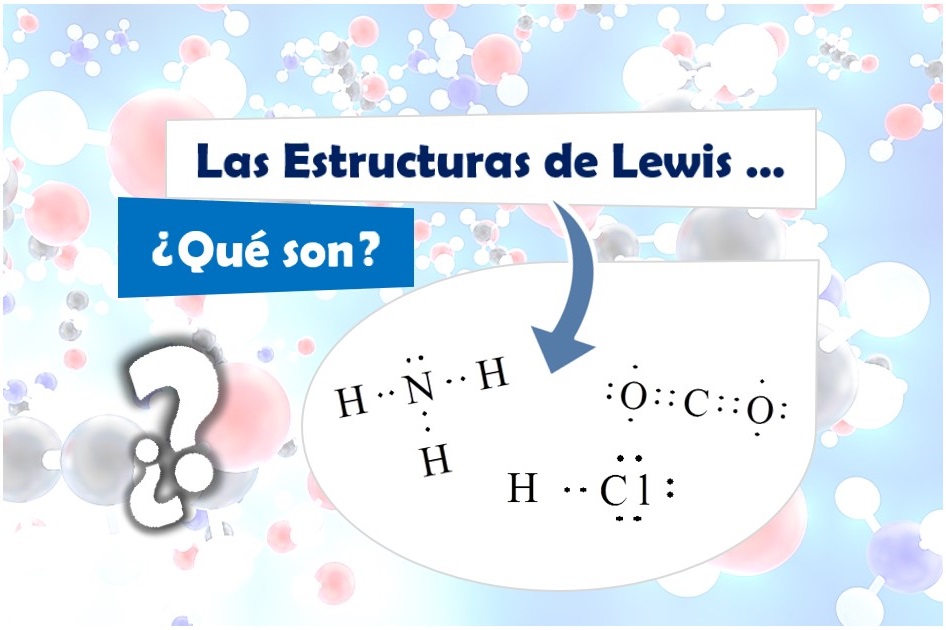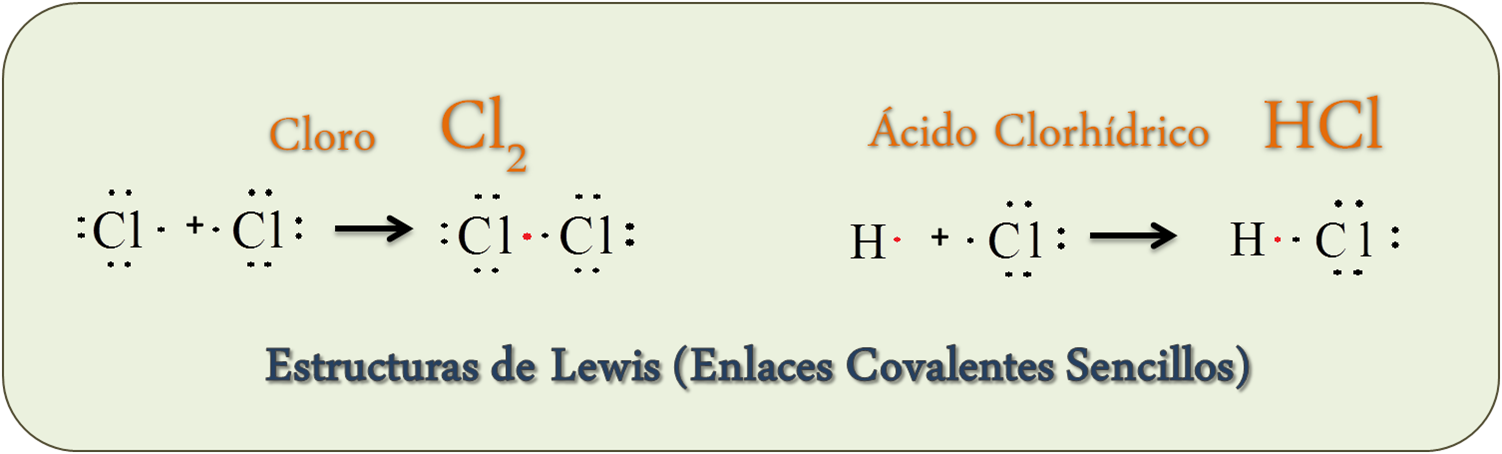
Continuamos con nuestro Diccionario de Química explicando qué son las estructuras de Lewis.
Soy Mónica Blanco y, hoy aquí en De Ciencias, te lo explicamos ¿Me acompañas?
Vídeo explicativo: ¿Qué son las Estructuras de Lewis?
¿Qué son las Estructuras de Lewis?
Las estructuras de Lewis, también denominadas Modelo de Puntos de Lewis o Fórmula de Lewis, son una forma sencilla de representar gráficamente tanto los iones como los compuestos.
Gracias a las estructuras de Lewis podemos visualizar de cada elemento:
– El número de electrones de valencia (Electrones situados en la última capa), simbolizadas por puntos.
– Los pares de electrones que forman parte de los enlaces (simbolizado por puntos o líneas).
– Los pares de electrones solitarios (simbolizado por puntos, aunque podemos encontrarlo escrito por líneas).
- Estructuras de Lewis del cloruro sódico y cloruro de magnesio – Enlaces iónicos
- Estructuras de Lewis del Cloro y ácido clohídrico – Enlaces Covalentes sencillos
Se suele utilizar los Modelo de Puntos de Lewis para representar moléculas sencillas con enlaces covalentes, los enlaces iónicos de suele representar por redes cristalinas.
¿Cómo dibujar estructuras de Lewis? Estructuras de Lewis y Regla del Octete
Antes de nada, para poder dibujar las estructuras de Lewis debemos sabernos la Tabla Periódica o, es su defecto, tenerla a mano para consultar si nos hace falta.
¿Por qué nos debemos saber la Tabla Periódica?
Porque en ella consultaremos el Número Atómico (Número de protones) de cada uno de los elementos de la Tabla Periódica y, como sabréis, el número de protones es igual al número de electrones, dato esencial para representar las Estructuras de Lewis.
De esta manera os resultará mucho más sencillo no sólo entender sino saber dibujar correctamente las Estructuras de Lewis.
¿Necesitamos saber la configuración electrónica de los elementos para poder dibujar las Estructuras de Lewis?
En principio Sí, debemos saber el número de electrones de la capa más externa o capa de valencia, electrones necesarios para formar enlaces con otros átomos.
Es posible que todavía no sepas lo que son las Configuraciones Electrónicas de los elementos, pero
Pero ¿Existe un Truco para saber los electrones de valencia? Sí, a continuación os mostramos los siguientes trucos para dibujar la estructuras de Lewis de forma muy sencilla
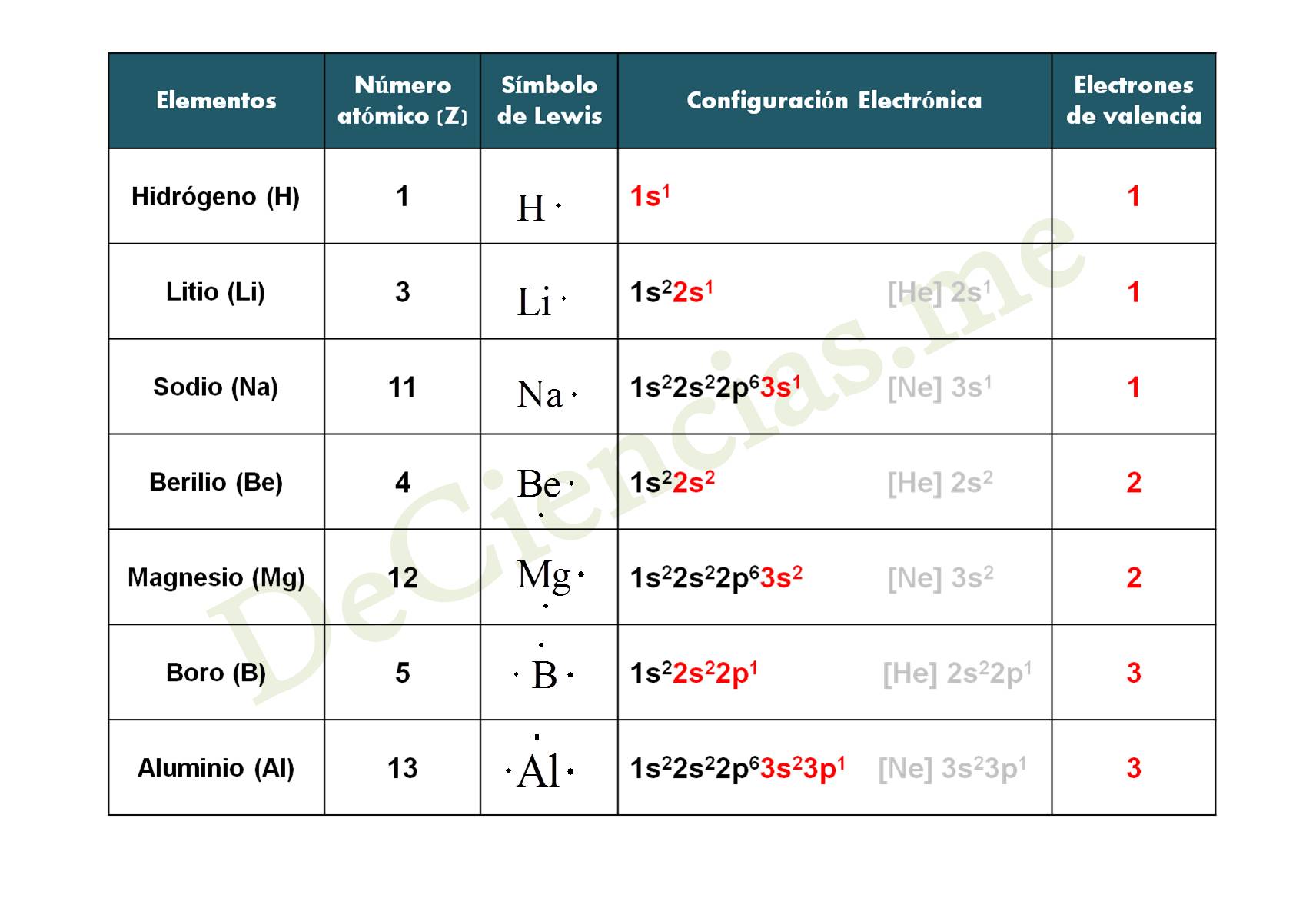
1º) Debemos saber cómo se ordenan los elementos en la tabla Periódica:
Grupo 1: Litio, Sodio, Potasio, …
Grupo 2: Berilio (Be), Magnesio (Mg), Calcio (Ca), …
Grupo 13: Boro (B), Aluminio (Al), Galio (Ga), …
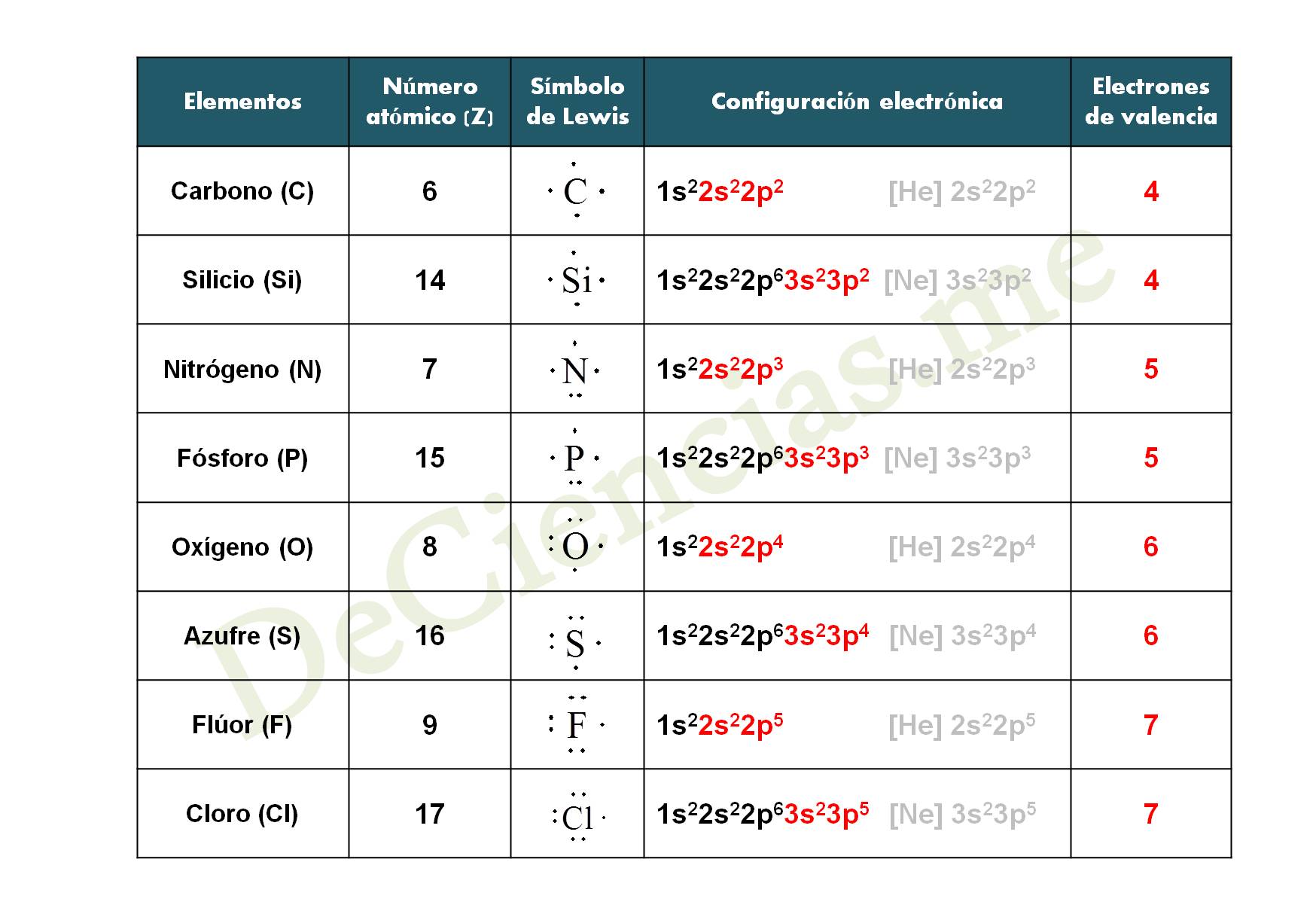
Grupo 14: Carbono (C), Silicio (Si), Germanio (Ge),…
Grupo 15: Nitrógeno (N), Fósforo (P), Arsenio (As),…
Grupo 16: Oxígeno (O), Azufre (S), Antimonio (Sb),..
Grupo 17: Flúor (F), Cloro (Cl), Bromo (Br), Iodo (I), …
Grupo 18: Helio (He), Neón (Ne), Argón (Ar), …
Para que os resulte mucho más fácil de memorizar, los elementos del:
– Grupo 1 sólo tienen 1 electrón de valencia
– Grupo 2 tienen 2 electrones de valencia
– Grupo 13 tienen 3 electrones de valencia
– Grupo 14 tienen 4 electrones de valencia
– Grupo 15 tienen 5 electrones de valencia
– Grupo 16 tienen 6 electrones de valencia
– Grupo 17 tienen 7 electrones de valencia
– Grupo 18 tienen 8 electrones de valencia
Pasos a seguir para dibujar las Estructuras de Lewis
Las Estructuras de Lewis se dibujan de la siguiente manera:
1º) Se pintan los símbolos químicos de cada elemento
Con los símbolos químicos se representan las configuraciones internas de ese elemento (Los electrones de las capas internas y su núcleo) y alrededor de él, mediante puntos, se representan los electrones de valencia, es decir, aquellos electrones situados en la capa más externa.
Ejemplos de Estructuras de Lewis:
- Estructuras de Lewis del dioxido de carbono y el amoniaco
En la Estructura de Lewis siempre debemos situar al elemento más electronegativo en el centro de la molécula (cuando está formada por tres átomos) o a la derecha (cuando está formada por dos átomos).
Los elementos más electronegativos son aquellos que están situados más a la derecha y más arriba de la Tabla Periódica (Propiedades Periódicas de los elementos).
Os dejamos a continuación una tabla con las configuraciones electrónicas de los distintos elementos de la Tabla Periódica que veremos en el vídeo de los ejemplos de Estructuras de Lewis y en el vídeo de Configuraciones Electrónicas.
- Tabla 1 – Estructuras de Lewis
- Tabla 2 Estructuras de Lewis
🧪 ¿Te has perdido el último post de … Un Fisquito de Ciencias? 👇
¿Por qué celebramos el día Mundial de las legumbres?
¿Por qué celebramos el Día Mundial de las Legumbres?...
La Aspirina, aliado de la primera guerra mundial
[Historia de la ASPIRINA -Un Fisco de Ciencias] Piensa un...
2º) Contar el número de electrones de valencia de cada átomo
Si sumamos los electrones de valencia de todos aquellos átomos presentes podremos saber cuántos electrones están apareados y desapareados (solitarios)
¿Cómo podemos saber cuántos enlaces se forman en la molécula?
Podemos saber cuántos enlaces se forman en la molécula si restamos el número total de electrones necesarios para completar el octete menos el número de electrones de valencia totales de cada átomo. De esta manera podemos saber el número de electrones que forman parte de los enlaces y cuántos los enlaces tienen la molécula.
Nº de e– Forman Enlaces = Nº de e– Completar Octeto – Nº de e– Valencia Totales de todos los átomos.
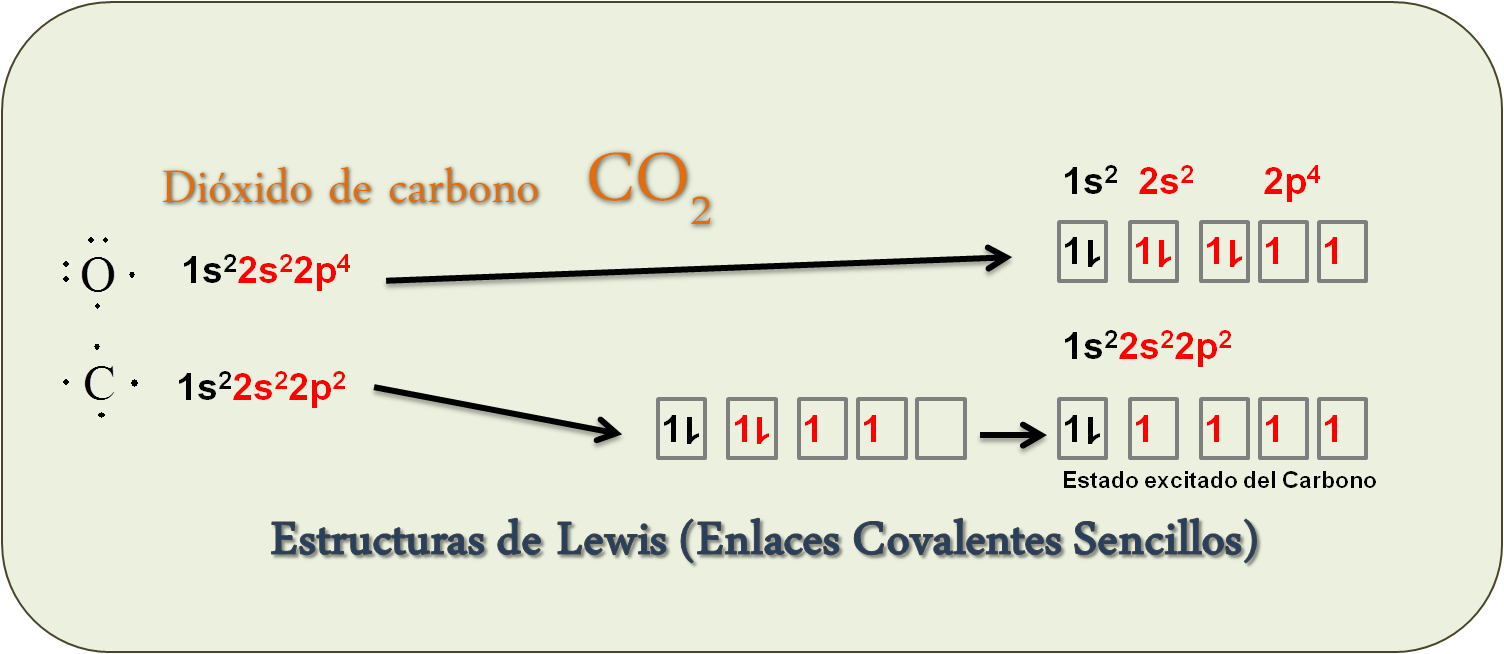
Ejemplo: CO2
C [He] 2s22p2
O [He] 2s22p4
Nº de e– Valencia
C: 4 electrones de valencia
O: 6 electrones de valencia, como tenemos dos oxígenos será 6×2 = 12 electrones totales
Total: 12 + 4 = 16 electrones
Nº de e– Completar Octeto
C: 8 electrones
O: 8 x 2 átomos = 16 electrones totales
Total: 16 + 8 = 24 electrones
Nº de e– Forman Enlaces: 24 – 16 = 8 electrones forman enlace
Como cada enlace tiene dos pares de electrones, dividimos 8 entre 2 y nos da 4 enlaces son necesarios para formar la molécula de dióxido de carbono (CO2)
¿Se puede calcular el número de electrones desapareados, es decir, los electrones no enlazantes?
Sí, Restando el Nº de e– Valencia menos el Nº de e– Forman Enlaces.
16 – 8 = 8 electrones desapareados (8/2= 4 pares de electrones no enlazados
Debemos tener en cuenta que las estructuras cargadas, es decir, los aniones o cationes, debemos sumar o restar el número de electrones correspondientes a las cargas añadidas. Por ejemplo: en el caso del ion amiduro NH2–, debemos sumarle un electrón al cálculo total de electrones debido a la carga negativa del ion.
¿Cuántos enlaces pueden formar cada elemento?
El número de enlaces dependerá de los electrones de valencia desapareados que tenga dicho elemento. Por esta razón:
Los elementos del Grupo 1 sólo pueden formar un enlace con otro elemento de la Tabla Periódica
Los elementos del Grupo 2 sólo pueden formar dos enlaces con otros elementos de la Tabla Periódica
Los elementos del Grupo 13 sólo pueden formar tres enlaces con otros elementos de la Tabla Periódica
Los elementos del Grupo 14 sólo pueden formar cuatro enlaces con otros elementos de la Tabla Periódica
Los elementos del Grupo 15 sólo pueden formar tres enlaces con otros elementos de la Tabla Periódica porque sólo tienen tres electrones desapareados.
Los elementos del Grupo 16 sólo pueden formar dos enlaces con otros elementos de la Tabla Periódica porque sólo tienen dos electrones de valencia desapareados.
Los elementos del Grupo 17 sólo pueden formar un enlace con otros elementos de la Tabla Periódica porque sólo tienen un electrón de valencia desapareados.
Los elementos del Grupo 18 no tienen electrones de valencia desapareados, por este motivo, no formarán enlaces con otros elementos de la Tabla Periódica.
3º) Dibujar los Enlaces en las Estructuras de Lewis (Regla del Octeto)
Todos los electrones de valencia se indican con puntos. Los átomos se unirán mediante enlaces covalentes o iónicos para conseguir la estabilidad necesaria y eso se consigue con ocho electrones a su alrededor.
Aquellos elementos de la Tabla Periódica que no tengan en su capa externa ocho electrones se unirán a otros para conseguir la configuración de Gas Noble más cercano, completando así su nivel energético y alcanzando la estabilidad deseada (Los Gases Nobles son especialmente estables por tener ocho electrones en su capa electrónica más externa y estos elementos no se enlazan con otros elementos en condiciones normales). Esto es lo que se conoce por la Regla del Octeto.
Existen excepciones, por ejemplo, el H tiene una configuración electrónica 1s1 y para ser estable sólo necesita dos electrones en su capa de valencia. ¿Eso qué quiere decir? Eso quiere decir que tiene un electrón en su capa de valencia y sólo necesita otro electrón para conseguir la configuración electrónica de Gas Noble más cercano, eso quiere decir, conseguir la configuración del Helio 1s2.
¿Cómo consiguen electrones los átomos de los elementos?
Los átomos son capaces de conseguir ocho electrones en su capa electrónica más externa cediendo o aceptando electrones ¿Cómo? Mediante transferencia de electrones (Enlaces Iónico) o por compartición de electrones (Enlace covalente):
– Enlaces Iónicos (Enlaces entre un elemento Metálico y otro No metálico). Los elementos que forman dichos enlaces quieren cosas diferentes, uno quiere ganar electrones y el otro quiere perder electrones para ser estable. Se suelen representar normalmente por redes cristalinas y no por estructuras de Lewis. Ejemplo NaCl o el MgCl2.
- Estructuras de Lewis del cloruro sódico y cloruro de magnesio – Enlaces iónicos
– Enlaces Covalentes puros (Enlaces entre elementos No metálicos). Los elementos que forman dichos enlaces quieren ganar electrones y la única forma para ser estable es compartiéndolos. Ejemplo: Cl2, HCl, CH4.
- Estructuras de Lewis del Cloro y ácido clohídrico – Enlaces Covalentes sencillos
En resumen, los átomos se unirán entre sí para formar moléculas sencillas.
Existen elementos con pares de electrones no apareados
Existen elementos de la Tabla Periódica que pueden contener pares de electrones de valencia que no formen enlace, estamos hablando de los pares de electrones solitarios.
Esto le suele suceder a aquellos elementos situados a la derecha de la Tabla Periódica como por ejemplo el Nitrógeno, el oxígeno, etc. Todas estas excepciones las veremos en el vídeo de los ejemplos de Estructuras de Lewis.
Ahora bien, sabiendo toda esta información, debemos tener en cuenta que sólo formarán enlaces los electrones desapareados, es decir, aquellos que no han formado pareja (spin +1/2, -1/2)
¿Recuerdan las cajitas utilizadas para situar los electrones en los distintos niveles energéticos? Pues esas cajitas, más correctamente denominados Diagramas de orbitales, sirven para indicar cuántos electrones caben en cada orbital, los verás más claro en el vídeo de Configuraciones Electrónicas.
Algunos átomos no tienen suficientes electrones desapareados por lo que su única opción es promover los electrones a otras capas, con un coste energético mínimo, que les permitirá conseguir compartirlos para obtener la configuración de Gas Noble.
Ejemplos de Elementos con pares de electrones No Apareados
Por ejemplo, en el caso del Berilo el átomo tiene 2 electrones de valencia (Configuración electrónica 1s22s2), eso quiere decir, que tiene dos electrones en su capa más externa, dos electrones en el orbital 2s.
Dicho elemento necesita promover un electrón al orbital p (2p) para tener finalmente los 2 electrones desapareados y poder así conseguir la configuración de Gas Noble. Los verás más claro en el vídeo de ejemplos de Estructuras de Lewis.
También le sucede al Carbono, necesita promover un electrón al orbital p para tener un total de cuatro electrones para formar cuatro enlaces como, por ejemplo, con el oxígeno del dióxido de carbono: CO2.
- Estructuras de Lewis del dioxido de carbono y el amoniaco
4º) Asignar las cargas a los átomos de la molécula.
Existen moléculas cargadas, como es el caso del ion hidronio (H3O+) o el ion amonio (NH4+). Por esta razón, debemos asignar cargas a los átomos de la molécula sumando (En el caso de aniones) o restando (En el caso de los cationes) el número de electrones oportunos a las cargas adicionales para que cumplir la regla del Octete.
Un átomo está cargado si la suma difiere del total de electrones de la capa de valencia en el átomo libre y no enlazado.
¿Se puede calcular dicha carga formal de un átomo? Sí, la carga formal se puede calcular de la siguiente manera:
Carga Formal=(Nº de e- de valencia)-(Nº de e- desapareados)
-1/2(Nº de e- enlazados)
Carga formal = (Nº de e- de valencia)-(Nº de e- de enlaces + e- no compartidos)
Por ejemplo, en el CO2 su carga formal sería CF del oxígeno= 6-4-2=0
En Química Orgánica existen moléculas que presentan varias estructuras de Lewis, estamos hablando de las estructuras de resonancia que podemos encontrar por ejemplo en el NO, el CO32-, CO2, el O3, Anión acetato (CH3CO–), catión 2-propenilo o alilo (CH2=CH-+CH2) que veremos en otro vídeo del Diccionario de Química Orgánica, los cuales tienen híbridos de resonancia.
¿Se pueden utilizar Guiones en vez de puntos en las Modelos de Lewis?
Cuando tengamos que dibujar moléculas más complejas, los enlaces covalentes de las estructuras de Lewis se pueden representar por guiones, así resulta más sencilla la representación de los enlaces múltiples como dobles y triples enlaces. Los pares de electrones no enlazados se suele representar por puntos.
El químico alemán August Kekulé fue el primero es utilizar este tipo de anotación por guiones y sus estructuras son conocidas como estructuras de Kekulé.
- August Kekulé
En resumen, para conseguir el octete, es necesario forman:
– Enlaces sencillo (con 2 electrones)
– Enlaces múltiples: dobles (4 electrones) y triples (6 electrones)
para adquirir la configuración de Gas Noble (8 electrones).
¿Aún NO has comenzado el Curso de Formulación y Nomenclatura de Química Orgánica? ¡A QUÉ ESPERAS!
💥 Déjame tu comentario 💥
¡ME QUIERO ENTERAR!

Creación, Redacción y Edición del Vídeo: Mónica Blanco
#DiccionariodeQuímicaOrgánica #QuímicaOrgánica
#UnFisquitoDeCiencias #DivulgacióndelaCiencia #DivulgaciónCientífica #CulturaCientífica #Ciencia #MónicaBFreijo
DeCiencias está distribuido bajo una Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
(CC BY-NC-ND 4.0)
¿Te pica la CURIOSIDAD? 👇
¿Por qué celebramos el día Mundial de las legumbres?
¿Por qué celebramos el Día Mundial de las Legumbres?...
¿Por qué se celebra el Día Internacional de la Mujer y la Niña en la Ciencia?
Cada 11 de febrero se celebra en todo el mundo un día muy...
Las agujetas musculares, ¿qué son y cómo aliviarlas?
Esta semana me gustaría hablarte de uno de los mitos más...
¿Me sigues?
¿Te GUSTARÍA llevar algo De Ciencias ? Entra en … ⚗️ 👇
Tienda Online de Regalos Ciencias
¡No te lo pierdas!